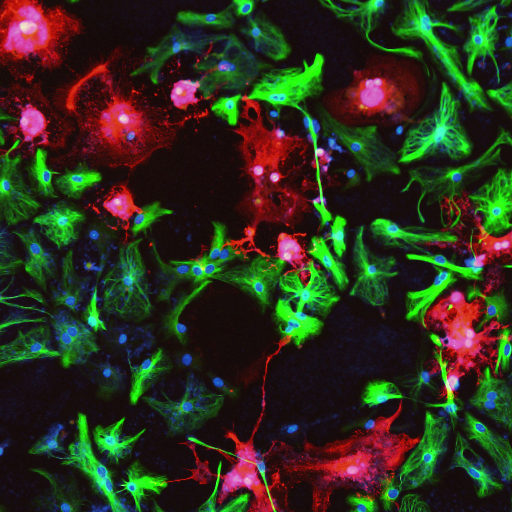
多細胞生物は、細胞・臓器間のコミュニケーションを密に行ない、変動する環境に対応しています。吉澤は、臓器連関を介した生体の複雑な恒常性維持機構を、遺伝子の発現制御に代表されるシグナル伝達に着目して研究してきました(<これまでの成果>参照)。
2024年4月に着任した当研究室でも、細胞・臓器間シグナル伝達経路の新たな仕組みを解明し、生物の巧みな恒常性維持機構を読み解いていく所存です。各プロジェクトは以下のとおりで、分子生物学・細胞生物学・生化学・内分泌代謝学などの様々な研究手法を組み合わせることで、ミクロな分子レベルから細胞・個体レベルの解析を行っています。
1)運動器を基軸とした新たな生体の恒常性維持機構の解明
骨組織や骨格筋はホルモンを分泌して他臓器の機能を調節しているため、運動器の障害は寝たきりのリスクのみならず、全身の恒常性維持や寿命にも影響を及ぼします。そこで、以下の二つの研究を推進し、既存の概念を超えた病態機序の解明や新たな予防・治療法開発のシーズになることを目標とします。
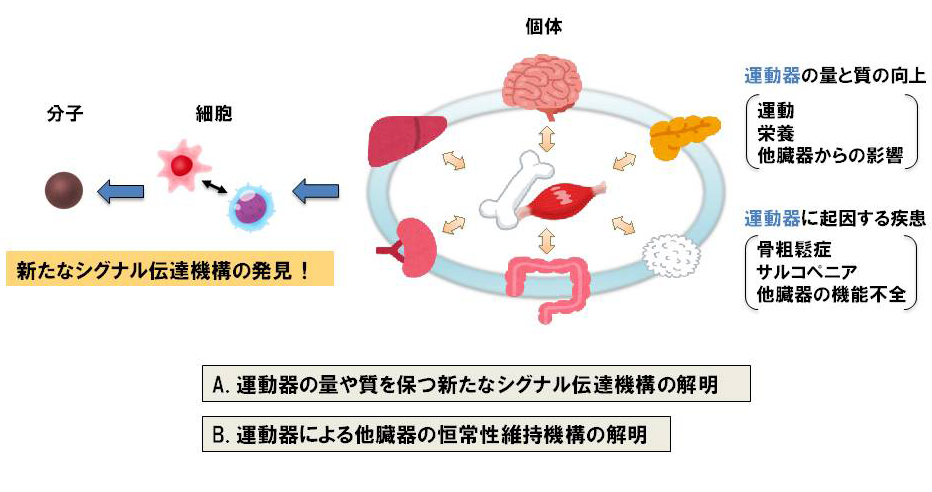
A. 運動器の量や質を保つ新たなシグナル伝達機構の解明
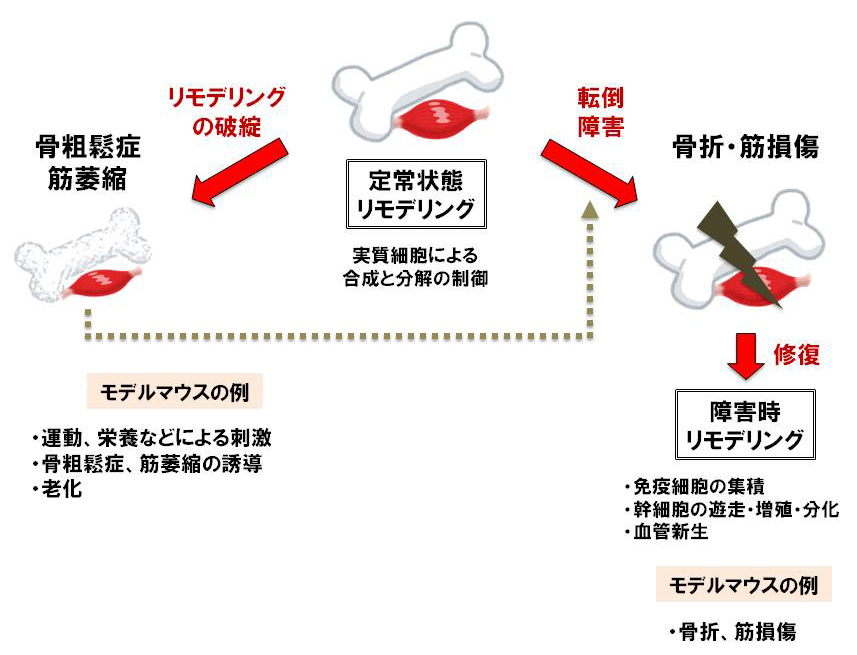
運動器のリモデリング(再構築:合成(形成)と分解(吸収)の繰り返し)には、定常状態のリモデリングと骨折や筋損傷などの障害時リモデリングがあります。骨と骨格筋の恒常性維持に関わる新規因子を発見するため、それぞれの段階にあったリモデリングを操作した各種モデルマウスを作成し、遺伝子発現の網羅的解析やタンパク質の解析を行っています。現在、骨芽細胞による骨髄中の血管と神経の調節機構や、免疫細胞による骨格筋再生の新しい制御機構を見出しています。今後も健康長寿につながる新しい運動器恒常性維持機構の解明を目指します。
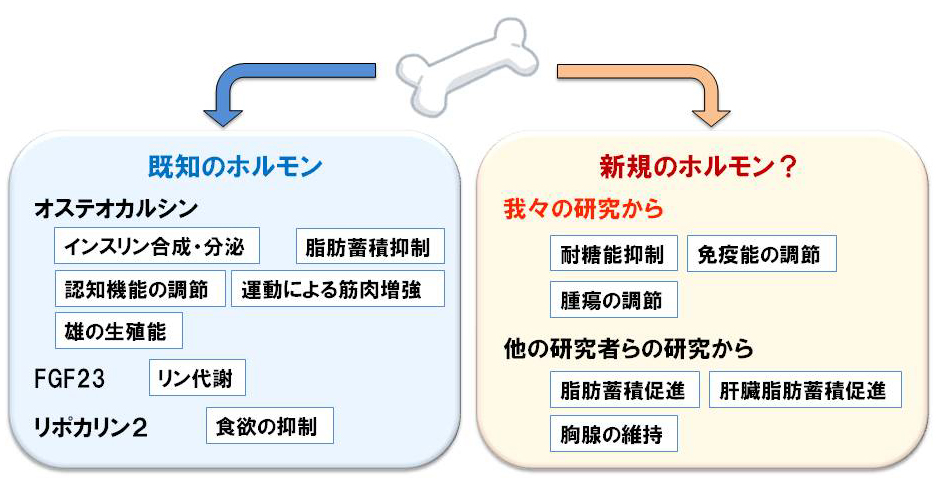
B. 運動器による他臓器の恒常性維持機構の解明
最近私は、既知骨ホルモンでは説明できない骨の新しい内分泌作用を発見しました(未発表)。そこで、新規骨ホルモンの発見および骨組織による新たな生体機能調節機構の解明を目指して解析を進めています。現在、新規骨ホルモンの候補をスクリーニングし、分子レベルから細胞・個体レベルの解析を行っています。
2)脂質による新たなタンパク質翻訳後修飾の研究
脂質によるタンパク質翻訳後修飾は、タンパク質の局在・安定化・活性などを制御し、シグナル伝達経路などに深く関わっています。そこで、脂肪酸アシル化修飾による生体恒常性維持機構とその変容による疾患を研究し、新たな概念の構築や生命現象の根幹に関わる研究を推進していきます。
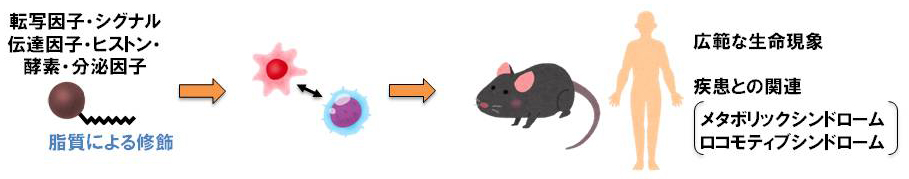
A. 新規翻訳後修飾によるホルモン核内受容体制御機構の解明
ホルモン核内受容体の新たな翻訳後修飾をスクリーニングし、新しい機能調節機構を解析しています。現在、筋萎縮に関わるグルココルチコイド受容体の新規翻訳後アシル化修飾を見出しており、ステロイド薬の副作用軽減法開発への足がかりにしたいと考えています。
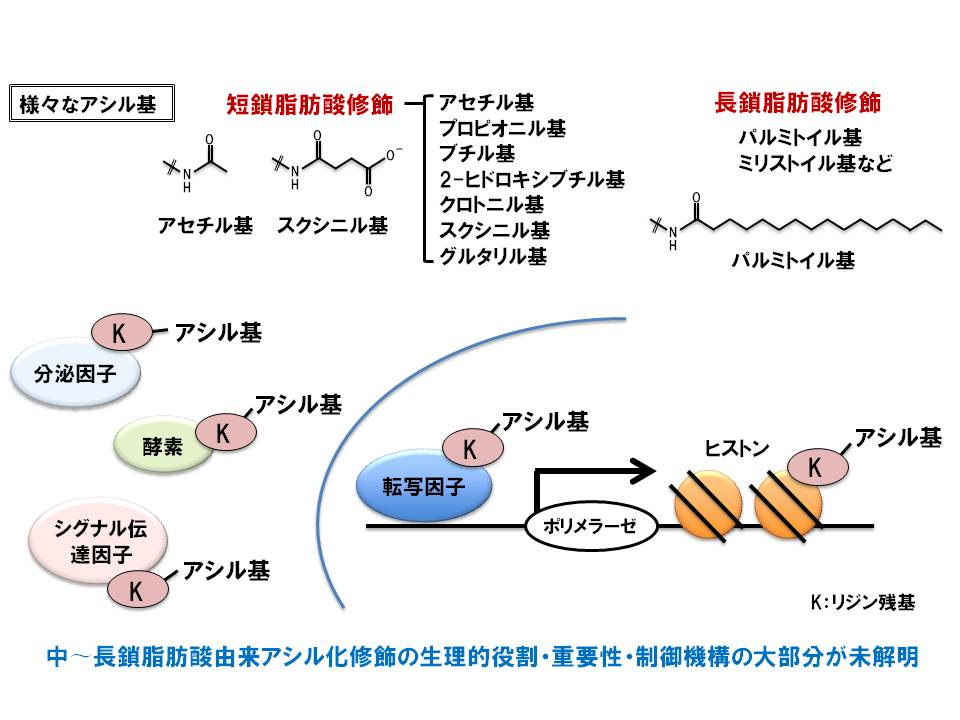
B. 中鎖脂肪酸由来アシル化修飾の研究
最近私は、世界でも報告のないリジン残基への中鎖脂肪酸アシル化修飾を発見しました(未発表)。中〜長鎖脂肪酸由来アシル化修飾の研究報告は世界でも極めて少なく、大部分が未解明です。今後も、a.中鎖脂肪酸アシル化修飾機構の解明、b.新規中鎖脂肪酸アシル化修飾タンパク質の同定とその機能解析、c.中鎖脂肪酸アシル化修飾の個体レベルでの役割解明など、独創的な研究を展開していきます。
3)応用研究
研究の社会への還元の一環として応用研究も進めており、骨に特異的に薬剤を届ける手段として、骨指向性ドラッグデリバリーシステムの開発を他大学と共同で進めています。現在、特許出願準備中であり、今後は応用・実用化を目指します。
細胞内には様々なタンパク質が存在しており、特定のタンパク質間相互作用が細胞分化やがんの増悪化に影響を与えることが明らかにされています。これまでに山田はヒト多能性幹細胞を用いた再生医療研究とがんモデルの作成、および腫瘍の悪性化に関与しているタンパク質間相互作用の機能解明に関する研究に取り組んできました。
2024年12月に着任した本研究室では様々なタンパク質間相互作用に着目することで、がんに対する新規治療法の開発および細胞の運命決定/分化指向性の制御機構の解明を目指した研究を展開していきたいと考えています。
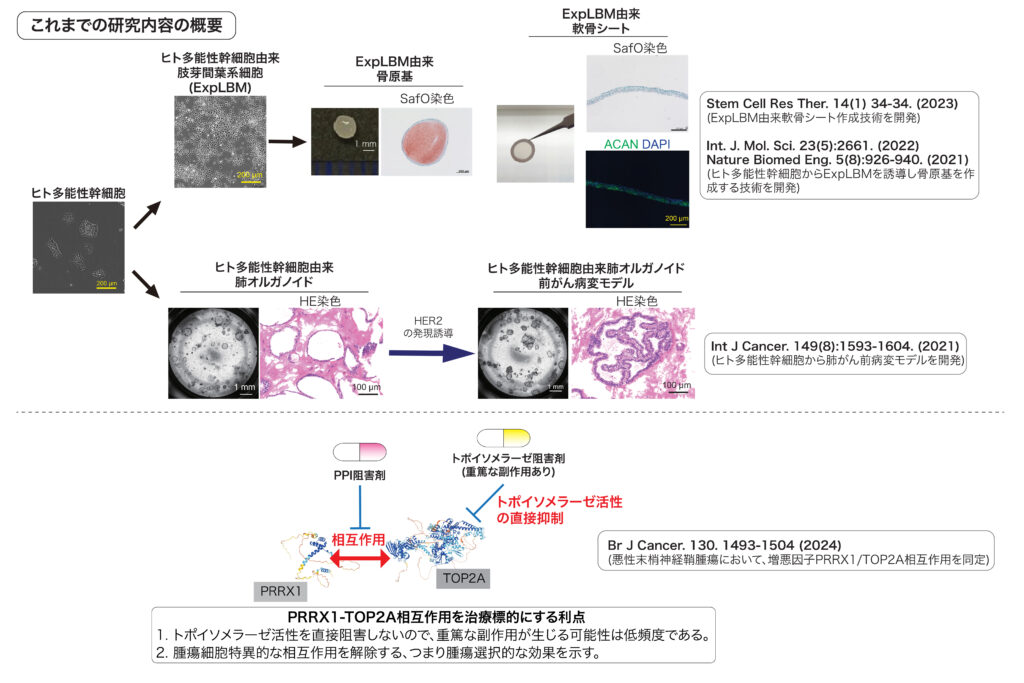
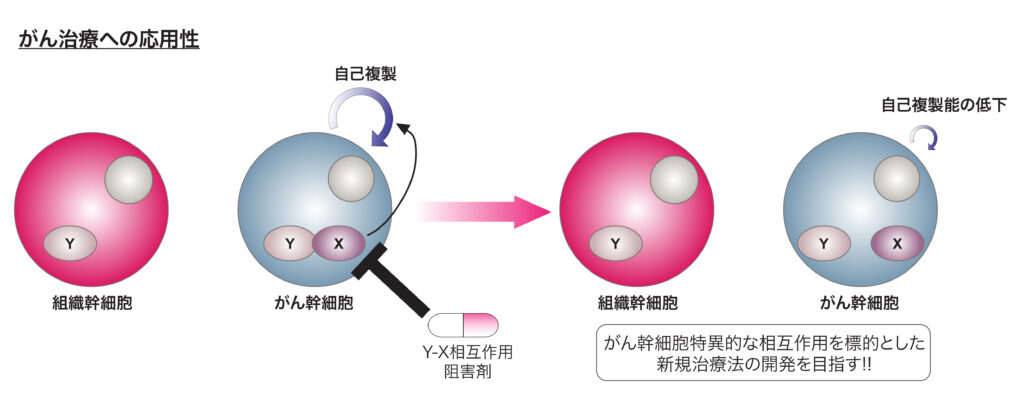
A. タンパク質間相互作用を介した腫瘍の悪性化機構の解明
生体組織には多分化能(組織中に存在している特定の細胞に分化する能力)と自己複製能を有している組織幹細胞と呼ばれている細胞が存在しており、同細胞は組織の形成や再生に重要な役割を担っています。がんには腫瘍原性能(腫瘍を形成する能力)、薬剤抵抗性および自己複製能を有しているがん幹細胞と呼ばれている細胞が存在しており、これまでに同細胞を治療標的とするための研究が多く発表されています。組織幹細胞とがん幹細胞の両方で同一分子が維持に必須であるというケースもありますが、どんな違いがあるのか??という点に関しては実は未解明なことが多いです。その違いを動物モデルやヒト多能性幹細胞由来病態モデルを用いて解明することで、我々はより腫瘍選択的な治療法の開発を目指します。
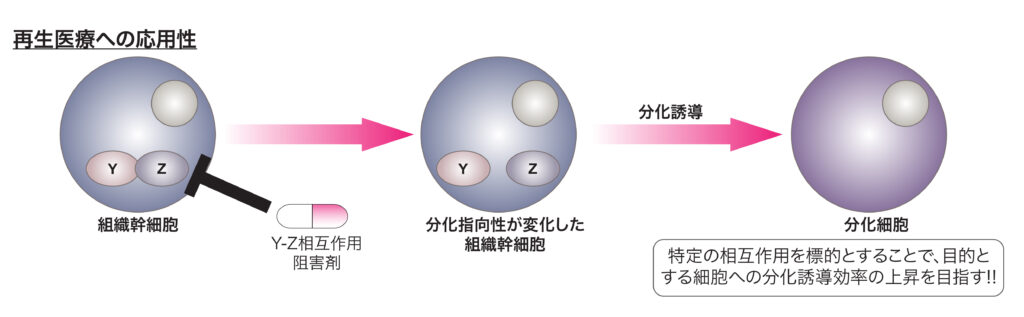
B. タンパク質間相互作用を介した細胞の運命決定/分化指向性の制御機構の解明
多能性幹細胞や組織幹細胞は様々な細胞に分化することが出来ますが、それらを選択的に特定の細胞へ分化誘導する技術に関しては十分には確立されていません。我々はタンパク質間相互作用という点に着目することで、細胞の分化指向性の制御機構の解明および再生医療への応用性が高い分化誘導技術の開発を目指します。
後藤(学内講師)の研究
「後藤(学内講師)」
神経系の発生と細胞内代謝の関係について研究してきました。特に、細胞内のグリコーゲン代謝が神経系の発生のみならず、炎症時に細胞が応答する際のエネルギー源として使用される代謝経路であることを見出してきました。また、神経系は骨格や筋にも多く投射し、その機能を調節したりフィードバックを受け取ることが報告されています。骨格や神経系との相関関係についての研究も展開していきたいと考えています。
A. 神経系の構築における細胞内代謝の役割
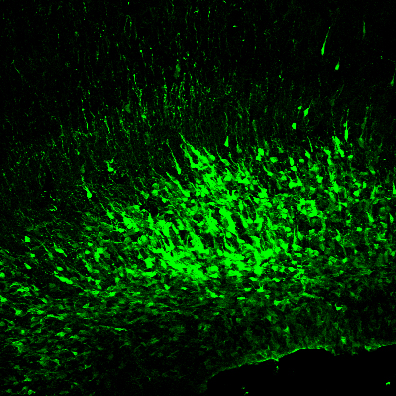
神経系の発生においては、時期や細胞種によって細胞の代謝が変化することが知られています。私たちは、神経系の幹細胞などでグリコーゲン代謝が活発に行われていることに着目し、その機能を解析してきました。マウスの新生仔期のアストロサイトでグリコーゲン代謝経路が活性化し、その増殖支持していることを見出してきました(Gotoh et al., J Cereb Blood Flow Metab 2017)。現在、グリコーゲン代謝に関連遺伝子を子宮内電気穿孔法によって、胎仔個体大脳皮質でのノックダウンを行って改変し、その影響を解析してきました。また、関連遺伝子のノックアウトマウスを用いた発生の解析も行っています。本研究では、組織学的解析や分子生物学的な解析法を用いています。
B. 神経炎症による発生機構の攪乱と長期間にわたる影響
発生時の特定の時期に炎症がおこることで、成体において自閉症のリスクが増大したり、不安様行動を呈しやすくなったり、てんかん発作の閾値が変動することが報告されています。我々は、海馬のシナプス形成期のマウスにおいて、細菌由来の毒素であるLPSが神経炎症を誘発する機序の解析を行っています。我々の解析では、LPSの投与によってアストロサイトが応答し神経細胞のシナプス形成等に影響しますが、アストロサイトの応答にグリコーゲン代謝が活性していることを見出しました。中枢神経での神経炎症応答に、特定のエネルギー代謝系の活性化が関与していることを示しました。